ROS1融合突变和靶向药物
2 q+ V* a" _8 @1 h( @ROS1融合突变和靶向药物
6 F* u7 A% t6 X( y! P& s% \$ dROS1基因也是肺癌中经常被提及的基因突变,但是其突变频率并不是特别高。另外很多患者和家属没有分清楚ROS1的突变形式,很多不靠谱的基因测序公司,对于ROS1基因上一个位点的突变都解析是药物敏感突变,对患者的靶向用药产生了极大的干扰。本帖注重对ROS1的基因突变形式、对应的靶向药物做一次系统梳理。
- E' s9 Y# O4 i& Z) y r1
) H* B$ E' }3 f1 O认识ROS1基因和其突变9 }8 ^4 n1 _1 b9 E3 k' U$ h
ROS1基因的重排最开始是在人脑胶质瘤细胞系里被鉴定出来,后续在其他几个恶性肿瘤里也发现了ROS1基因的重排,如胆管癌、卵巢癌、胃癌和非小细胞肺癌,其中在非小细胞肺癌里的突变频率为1%-2%。ROS1基因可与多个基因发生融合突变,其中最主要的融合伴侣是CD74,(见下面图片),ROS1与其他基因发生融合时,一般会保留激酶结构域,而且在断裂点上较为保守。ROS1的重排导致激酶持续激活,上调SHP-1、SHP2以及PI3K、AKT、mTOR、MAPK和ERK信号通路,导致细胞持续增殖,肿瘤发生。
) q$ \8 w1 N! H+ E) u# G
 0 {. [' c0 h% o9 R4 |3 r5 T
0 {. [' c0 h% o9 R4 |3 r5 T
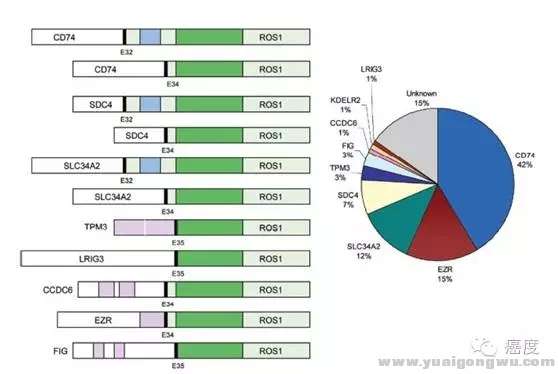
图1:非小细胞肺癌中ROS1基因的融合形式
' L- L& f& q; W! i: j0 d: F上图是ROS1基因的融合形式,左侧的绿色部分为ROS1的酪氨酸激酶结构域,蓝色部分为跨膜结构域。右侧部分是报道的与ROS1发生融合变异的基因和其频率。由于存在多种基因可能与ROS1基因发生融合,因此在选择检测ROS1的变异时,需要着重技术原理,避免漏检。检测ROS1突变的技术有FISH(原位免疫荧光杂交)、RT-PCR(逆转录PCR)、IHC(免疫组化)和新一代测序(NGS)。目前FISH是ROS1融合的金标准,通过红色和绿色荧光探针标记ROS1基因两端,如果ROS1基因没有发生断裂,那么红绿荧光凑在一起表现为黄色荧光信号。如果ROS1基因中间发生了断裂,则可以观察到红色荧光、绿色荧光信号的分离,如果大于15%的肿瘤细胞呈现出这种分离信号,则判断为ROS1基因融合突变阳性。
, s4 Q+ ?! s' w4 s
 / Z- d& L5 K. `/ M+ f
/ Z- d& L5 K. `/ M+ f
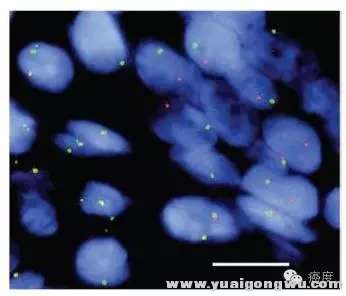
图2:FISH检测ROS1基因的重排
: D1 q% e& b9 h2 {+ }. @' W0 s 需要认识到任何检测技术都不是完美的,FISH的优势是可以检测石蜡切片组织(FFPE),这是RT-PCR不能具备的,RT-PCR对样本的RNA要求较高,需要新鲜的组织样本提取RNA才能进行逆转录。另外FISH还可以检测一些未知的融合突变,即不需要知道ROS1基因的融合伴侣是谁,只要ROS1发生分离了就行。缺点是手续繁琐、对试验员的操作要求较高。另外FIG基因在ROS1上游134kb处,因此FIG-ROS1的融合形式在荧光信号分离上不是很好判断。最关键的是FISH不能提供出和ROS1发生融合的伴侣基因是什么,是否有生物学和临床的意义。
9 A" n' Z+ M$ P( q" {RT-PCR因为需要之前设计引物,所以不能检测未知的融合突变形式。对样本的RNA要求较高,石蜡标本里RNA降解很严重。因此如果您的检测报告表明是RT-PCR检测的融合突变,而您的标本是石蜡标本,那么就需要注意是否存在假阴性的情况,不管是ALK或者ROS1以及RET都是这种情况。RT-PCR的优势是快速、样本需求量少。
) U( S0 l4 a6 g8 lROS1的免疫组化检测特点是简单,易操作。但是对抗体的要求较高,另外易受到染色背景、判读标准的影响,也有很多地方亟待提升。总之对于ROS1基因的融合突变,最好使用两种以上的检测技术进行相互验证,没有一项技术是可以做到100%的承诺的保证的,但是对于患者来说,漏检因为所有的希望。
8 l+ p5 c1 ^3 J* i1 t, y23 i3 b+ s, [9 U. U; Y
ROS1的患者和病理特点1 l. u' ~$ Q. b" w$ ]0 J3 N9 r. T
ROS1融合突变是非小细胞肺癌的一个亚型(突变频率1%-2%),ROS1的患者群与ALK突变的患者拥有一些共同的特征,患者的特点是年轻、非吸烟、亚裔、进展较快。尽管ROS1融合突变也在肺大细胞癌、鳞状细胞癌里被鉴定出来过,但是ROS1主要是存在于肺腺癌中。& D* ? C# H. X# b" U3 Q
ROS1基因与其他驱动基因突变是不共存的,一项涵盖1073个样本的研究表明ROS1与EGFR、ALK等突变互斥,没有发现他们共同存在。一项涵盖556个患者的研究也表明,使用免疫组化IHC检测ALK和ROS1,没有发现二者共存。后续有报道研究两名ROS1阳性的患者发现了EGFR突变,分别是L858R和19号外显子缺失突变。但是这些为个别案例,总体上肿瘤的驱动基因都是互相排斥的,因为肿瘤也不需要两种驱动基因驱动其增殖。" O9 n/ o7 \ K$ C6 z; X# x' `
3
. K1 ^, U# s" _9 \ k. `0 I治疗ROS1阳性的克唑替尼 P8 s+ e: O+ y) h! M
由于ROS1突变与ALK的相似性,研究者很容易想到使用ALK的抑制剂去尝试治疗ROS1的突变。2014年公布的临床研究数据表明,50名患者每日两次口服250mg克唑替尼,客观应答率(ORR)为72%,包含3例患者完全缓解(CR),33例患者部分缓解(PR)。相比ALK突变,ROS1患者使用克唑替尼的反应持续时间更长,达到17.6个月,中位无进展生存期(PFS)为19.2个月,因此专家推出克唑替尼对ROS-1的抑制要强于ALK,而且ROS1阳性突变的患者预后相对较好。
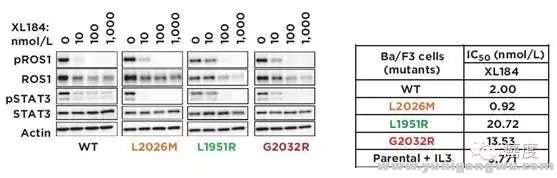
- n) B" n4 b! C, M6 x美国FDA于2016年3月11日批准将克唑替尼用于治疗ROS1突变的转移性非小细胞肺癌患者。也是第一个FDA批准的ROS1阳性的靶向药物。但是克唑替尼治疗ROS1阳性的患者也不可避免为会产生耐药,这些耐药原因包含ROS1基因上的一些点突变,如G2032R、L2155S、L2026M、G2101A、K2003I、L1951R等。其中ROS1的G2101A、L2026M和G2032R的肿瘤细胞系对Foretinib敏感,但是L2155S对于Foretinib仍然耐药。G2032R和L2155S细胞系对TAE684也是不敏感的。除去这两个药物外,卡博替尼(XL184)展示出与部分耐药位点的疗效,如图3,ROS1阳性克唑替尼耐药后的L2026M、L1951R和G2032R可以被卡博替尼所解决,对于ROS1阳性的患者来说这算是一个好的事情,虽然这些是细胞系的研究,但是希望还是有的。这些需要着重注意,基因检测报告需要仔细查询是否有这些耐药位点,这些耐药位点的释义和相应的意义。7 S" @. b, s. z( v! O R
 % [2 V' p4 J( i+ ~! w2 o1 D; ~
% [2 V' p4 J( i+ ~! w2 o1 D; ~
图3:ROS1的G2032等突变对卡博替尼敏感, `. n# k8 |1 B* K; Q+ U
ROS1患者在克唑替尼使用的另一个耐药机制是EGFR的代偿性高表达(表达量为2.6倍),这个在肿瘤细胞系中获得了验证,同时使用EGFR的靶向药物吉非替尼或西妥昔单抗联合克唑替尼,可以起到协同抑制的作用(见图4)。
M" v- s8 k5 E
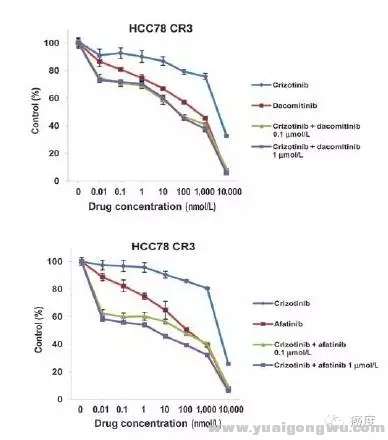
7 F f4 z- v- |/ \* z6 \图4:克唑替尼联合达克替尼或阿法替尼,可控制部分ROS1患者的耐药
" {; Y! o" q! M9 W5 ~2 D* f但是问题是,假如EGFR的高表达也确实是一部分ROS1患者的耐药原因,什么时候对患者进行检测呢,使用什么样本检测。检测的灵敏度和特异性如何?% \9 f4 w# I3 K$ Y; O! ^, u
钙粘附蛋白E表达量丢失,波形蛋白和人纤维连接蛋白表达增加是另外一种ROS1阳性患者对克唑替尼耐药的原因。这导致细胞形态,以及细胞之间的粘附力出现改变。& k+ i& @2 o2 k' G: g% n
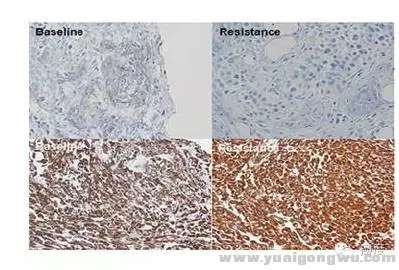
1 k6 g' U7 G! E5 X. l图5:一些蛋白表达降低或升高也影响ROS1患者对克唑替尼的敏感性
+ x, h4 @% X" \; s+ n3 v* m# _另外也有文献报道KRAS、NRAS等也对ROS1阳性的患者使用克唑替尼耐药,从肿瘤细胞的进化考虑,ROS1对克唑替尼的耐药原因会是比较复杂的,也比较难以预测。因此究竟是什么原因耐药,一定要彻底进行检测明确。推荐什么类型的靶向药物,必须有一定的文献或临床数据支持。/ v& W& _6 U/ W- N1 a9 W) j/ A
4* Q3 @$ Q% w4 O5 @5 h
其他ROS1融合阳性的靶向药物
+ M2 B0 J8 Z( v8 mALK和ROS1的激酶活性区域有70%的相似性,因此ALK的抑制剂很多是可以用于ROS1的治疗的,克唑替尼这个药物也就是这么误打误撞地搞出来的。其他的ALK抑制剂是否也可以呢?答案是有抑制效果但不都是。% ^+ `2 \5 P' j& H0 a, j6 j
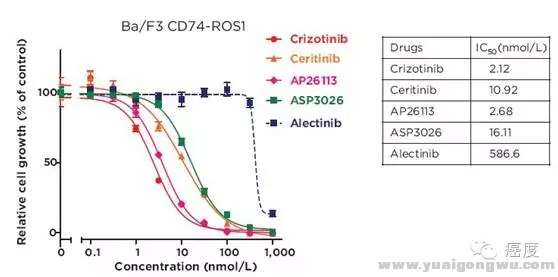 + ~# ?5 E0 I! n" G7 }( }# I
+ ~# ?5 E0 I! n" G7 }( }# I
图6:ALK抑制剂对ROS1-CD74融合基因的抑制情况
7 {+ O+ G6 E/ p4 r2 h在图1上我们可以知道CD74是ROS1的主要融合伴侣基因,所以表达该融合基因的细胞系被用来测试ALK的抑制剂。从图6我们可以看出,克唑替尼、色瑞替尼(LDK378)、AP26113对ROS1-CD74的抑制效果很不错。ASP3026具有中度的抑制效果,艾乐替尼(CH5424802)没有显示出具有抑制活性,这个是为主要注意的,因为艾乐替尼在ALK中和克唑替尼的头对头临床试验效果很好,但是这并不能完全复制到ROS1阳性的患者上,最起码不能复制到CD74-ROS1的融合突变的患者上。1 \5 d1 l$ G z2 Y5 G3 o
很多病友都熟悉3922这个ALK抑制剂,有资料称这个药物对于ROS1的抑制力度比克唑替尼强几十倍。我们查询了很多的文献,终于找到了一篇3922对ROS1的报道,给大家呈上。
# l5 {2 x: s/ K& j! ^- ]
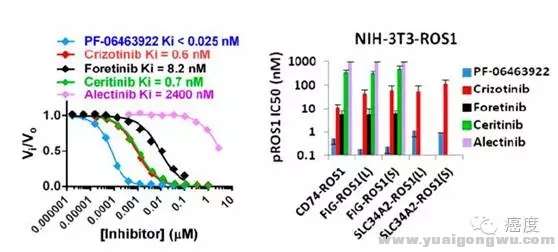 ) g8 @' `: `, Y8 P5 L* m
) g8 @' `: `, Y8 P5 L* m
图7:不同ALK抑制剂对ROS1的抑制活性,3922最优8 p, H' U# R- g- w
从图7中我们可以再次了解ALK抑制剂对ROS1突变的抑制活性,其实3922可以说是一骑绝尘。当然在这里我们再一次看到艾乐替尼对ROS1抑制不力,这个是需要着重注意的,不是所有的ALK抑制剂对ROS1都能起到好的抑制效果。9 Z& b0 ^, F7 o/ h" c R. Q
对于ROS1突变导致的克唑替尼耐药,体外实验表明3922可以ROS1基因上的G2032R突变、G2026M突变具有抑制效果。在动物模型的体内实验上,3922对于FIG-ROS1、CD74-ROS1和存在G2032R耐药突变的CD74-ROS1都具有抑制活性。另外对于FIG-ROS1阳性胶质母细胞瘤的老鼠上也展示出抑制效果。这里需要注意ROS1有多个耐药突变,目前报道的是其中两种是可以用3922控制的,当然这是动物实验,后续仍需要进行跟踪了解。1 l/ r( t, y/ j g$ v: ?2 ?
我们就本帖进行一次重点总结:& E* a8 _" q; t
ROS1的突变频率不是很高,在非小细胞肺癌里的频率仅为2%左右,但是目前有靶向药物克唑替尼批准。需要明确的是ROS1的突变形式是与其他基因发生融合。但是ROS1本身会产生一些耐药突变对克唑替尼耐药,这些耐药位点可以被其他靶向药物所解决,如卡博替尼、3922等。目前ROS1在其他癌种也有发现,但是跨癌种用药的疗效如果目前没有较为全面的报道,有胶质母细胞瘤脑的ROS1阳性老鼠对3922敏感。其他癌种如果检测出来ROS1阳性,且没有获准的靶向药物,跨癌种用药也是可以考虑的。% V" K# V3 x2 h/ q
小编的重要总结9 f* \ `2 a; t) V, P8 ^- v, [
4 U9 _" e8 G, S3 r% O: b参考文献:
1 P, a0 P% {; s: u3 K1、Kurtis D. Davies, et al., Clin Cancer Res. 2013 August 1; 19(15): 4040–4045.4 p, |7 r3 l- U1 b
2、Gainor JF, et al., Oncologist. 2013;18(7):865-75.( v" ^' N" U5 ~1 f$ ?+ K3 R9 h
3、Song A,et al.,Clin. Cancer Res. 21, 2379–2387(2015).
' j; {4 f6 P! p/ S! i4、Katayama R, et al.,Clin Cancer Res. 2015 Jan 1;21(1):166-74
% o6 H2 H5 H- t0 ~2 ]. T5、Zou HY, et al., Proc Natl Acad Sci U S A. 2015 Mar 17;112(11):3493-8. |